羊辞旧岁,金猴迎新。
在这喜迎新春之际,艾德生物再传佳音!我们自主研发的EGFR/ALK/ROS1基因突变联合检测试剂盒获得国家食品药品监督管理局(CFDA)批准上市(国械注准20163400037),真正为NSCLC临床精准诊疗实现EGFR/ALK/ROS1三基因同步检测!
包括NCCN、ASCO、ESMO以及国家卫计委、抗癌协会等国内外权威机构发布的规范、指南或共识[1-6]均明确指出NSCLC患者在治疗之前应先进行EGFR基因突变和ALK基因融合检测,并建议有条件的单位同时进行ROS1基因融合检测,并根据EGFR、ALK、ROS1的基因状况决定相应治疗策略。
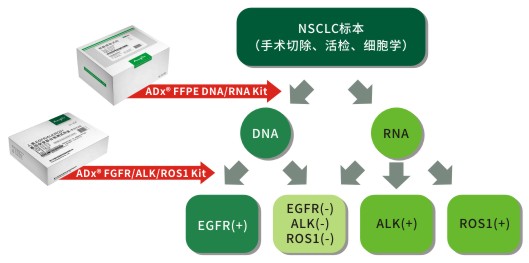
艾德生物系列产品为NSCLC精准医疗提供简便、快捷的完整检测方案,完全满足临床治疗决策需求。
【产品特点】
1、已获CFDA批准可同时检测EGFR、ALK和ROS1三种基因的试剂盒;
2、只需1-3片术后组织切片或活检、细胞学等小标本即可满足检测需求;
3、操作简便,6小时即可完成肿瘤组织标本DNA/RNA的同时提取和检测;
4、基于指南及共识推荐的ADx-ARMS和RT-PCR技术平台,判读客观;
5、检测覆盖基因及位点完全满足临床检测需求;
6、适用各型主流PCR仪。
【参考文献】
1、NCCN Guidelines, NSCLC, V2.2016
2、Reck M, et al. Ann Oncol. 2014
3、Natasha B. Leighl, et al. J Clin Oncol. 2014
4、中国原发性肺癌诊疗规范(2015年版)
5、晚期非小细胞肺癌分子靶向治疗专家共识. 2013
6、中国间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌诊疗指南,2015
关于艾德生物(股票代码:300685)
厦门艾德生物医药科技股份有限公司(股票代码:300685)聚焦在肿瘤精准医疗分子诊断领域,专注于科技惠民的技术创新,致力为患者提供合规、高品质的诊断产品和服务,让患者从精准医疗中真正获益。公司拥有国家企业技术中心、博士后科研工作站等资质,GMP标准厂房获得国家药监局(NMPA)和欧盟ISO13485资质认证;公司拥有ADx-ARMS®、Super-ARMS®、ddCapture®、ADx-HANDLE®等核心技术,核心技术获中、美、日、欧专利授权,荣获国家发明专利银奖,国家科技进步奖二等奖;公司产品覆盖具备精准医疗条件的各大癌种,多个产品至今尚无竞品,部分产品在日本、韩国获批上市并进入当地医保,开创了我国肿瘤伴随诊断海外获批的先例。公司下设厦门艾德医学检验所、上海厦维医学检验实验室,拥有医疗机构执业许可证、通过美国病理学会(CAP)认证,专业从事第三方临检服务。目前全球数十个国家和地区的数百家大中型医院选择了艾德产品,每年有数十万肿瘤患者从中受益。此外,艾德瞄准行业创新源头,以伴随诊断赋能原研药物临床,是众多顶级制药企业肿瘤伴随诊断的战略合作伙伴,是国际知名的民族品牌。





