
日前,艾德生物自主研发的HER2基因扩增检测试剂盒(FISH法)获得国家药监局(CFDA)《医疗器械注册证》(国械注准20153401471)和欧盟CE认证,成为目前国内获得CFDA批准同时适用于乳腺癌和胃癌HER2基因扩增临床检测的产品。
为了让客户得到直观的产品体验,艾德生物现已启动HER2产品预实验,全国三甲医院相关检测科室均可申请,详情请咨询我司销售代表/技术人员或致电垂询(全国免费服务电话400-065-0680)。
产品亮点:
I. 除乳腺癌外,还可适用于胃癌临床检测
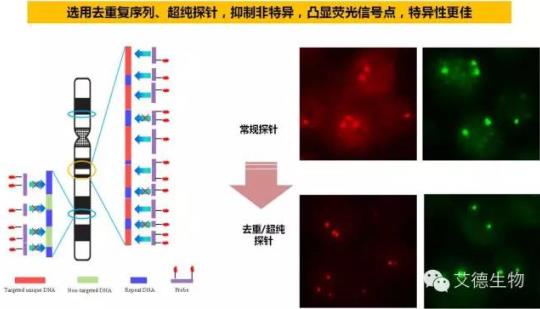
II. 采用自主研发的去重/纯化工艺获得的超纯探针,特异性更佳
人类基因组中存在大量重复序列,这些序列与常规探针杂交会引起一定的非特异,表现为较明显的背景点。艾德HER2产品采用三步去重、五步纯化工艺获得的去重/超纯探针,可显著降低非特异,凸显荧光信号,更利于FISH操作人员的镜下观察和结果判读。
背景介绍
乳腺癌是威胁女性健康的主要恶性肿瘤,据统计,中国每年有16.9万患者被新确诊为乳腺癌,其中,20%~30%的人群罹患的是HER2阳性乳腺癌。胃癌是全球第4大常见癌症及第2大致死癌症,我国男性及女性胃癌死亡率均高于世界平均水平。胃癌患者确诊时多为晚期转移患者且总生存率低。
目前临床诊疗界已达成共识,对HER2阳性乳腺癌和胃癌患者使用生物靶向药物治疗,可大幅提高患者生存率并改善生活质量,精确的HER2检测对于乳腺癌和胃癌靶向治疗患者的筛选起着决定性作用。值得注意的是,与我国胃癌流行病学数据相比,胃癌HER2检测数量仍很少;与文献报道的阳性率范围相比,我国临床检测的阳性率仍有待提高。
HER2扩增检测参考指南
乳腺癌
1. 2015年 NCCN Clinical Practice Guidelines in Oncology:Breast Cancer V3
2. 2013年Recommendations for HER2 testing in breast cancer :ASCO/CAP clinical practice guidline update
3. 2010年《HER2阳性乳腺癌临床诊疗专家共识》
胃癌
1. 2015年 NCCN Clinical Practice Guidelines in Oncology:Gastric Cancer V1
2. 2013年《人表皮生长因子受体2阳性晚期胃癌分子靶向治疗的中国专家共识》
由于篇幅限制,其它相关指南,不在此一一列出。
关于艾德生物(股票代码:300685)
厦门艾德生物医药科技股份有限公司(股票代码:300685)聚焦在肿瘤精准医疗分子诊断领域,专注于科技惠民的技术创新,致力为患者提供合规、高品质的诊断产品和服务,让患者从精准医疗中真正获益。公司拥有国家企业技术中心、博士后科研工作站等资质,GMP标准厂房获得国家药监局(NMPA)和欧盟ISO13485资质认证;公司拥有ADx-ARMS®、Super-ARMS®、ddCapture®、ADx-HANDLE®等核心技术,核心技术获中、美、日、欧专利授权,荣获国家发明专利银奖,国家科技进步奖二等奖;公司产品覆盖具备精准医疗条件的各大癌种,多个产品至今尚无竞品,部分产品在日本、韩国获批上市并进入当地医保,开创了我国肿瘤伴随诊断海外获批的先例。公司下设厦门艾德医学检验所、上海厦维医学检验实验室,拥有医疗机构执业许可证、通过美国病理学会(CAP)认证,专业从事第三方临检服务。目前全球数十个国家和地区的数百家大中型医院选择了艾德产品,每年有数十万肿瘤患者从中受益。此外,艾德瞄准行业创新源头,以伴随诊断赋能原研药物临床,是众多顶级制药企业肿瘤伴随诊断的战略合作伙伴,是国际知名的民族品牌。





