


人类ALK基因融合和ROS1基因融合联合检测试剂盒(荧光PCR法)
PCR
 PCR产品
PCR产品
产品特点
操作简便,易于开展
1
结果可靠,判读直观
2
灵敏度高,样本节省,仅需1-3片肿瘤组织切片
3
获NMPA批准可同时检测ALK、ROS1两种基因的试剂盒
4
产品简介
人类ALK基因融合和ROS1基因融合联合检测试剂盒采用RT-PCR技术,以NSCLC样本RNA为检测对象,对NSCLC中存在的多种ALK基因融合类型和ROS1基因融合类型同时进行检测,从而辅助临床更全面选择出可受益于克唑替尼的NSCLC患者。适用于NSCLC患者在进入靶向治疗之前使用,为肿瘤患者个体用药提供科学依据。
检测流程
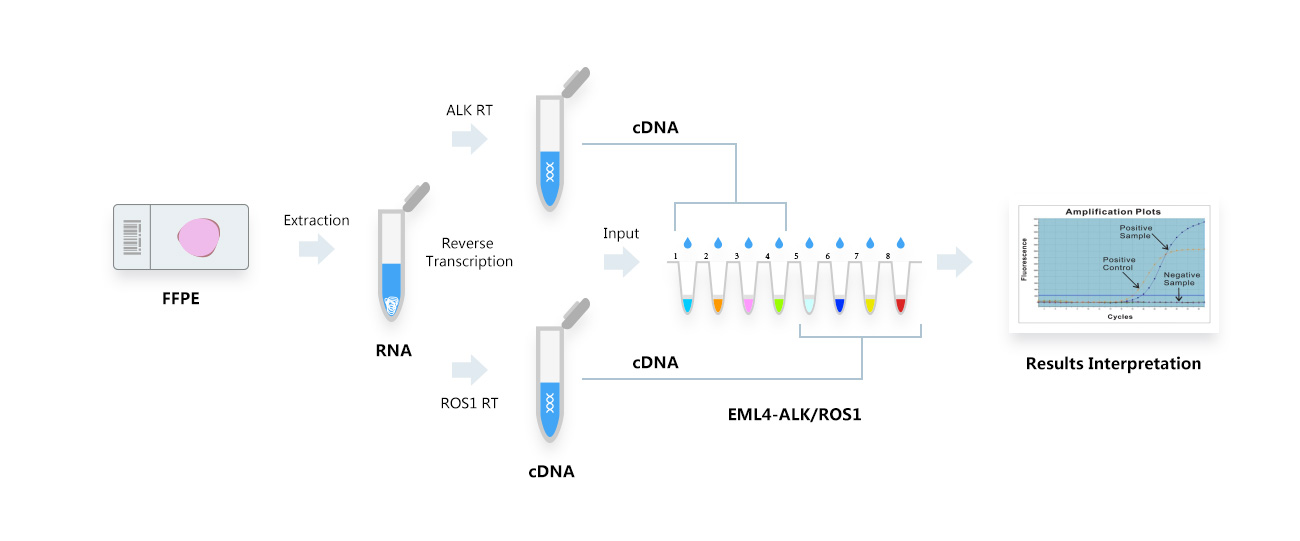
适用检测样本:(新鲜组织、冰冻组织、石蜡包埋组织等)
其它介绍
ALK融合基因和ROS1融合基因是非小细胞肺癌中多见的基因变异类型。多种基因,如EML4、KIF5B、TFG、KLC1可以与ALK基因发生融合,SLC34A2、CD74、SDC4、EZR、TPM3、LRIG3、GOPC可以与ROS1基因发生融合。融合的发生激活了与细胞存活和增殖相关的信号转导通路,进而引起肿瘤的发生。ALK基因融合和ROS1基因融合在NSCLC中的发生率分别为3-11%和2-4%,多发生于年轻、非吸烟的腺癌患者;两者融合通常不同时发生。美国国立综合癌症网络(NCCN)临床实践指南和欧洲肿瘤内科学会(ESMO)肺癌共识均明确指出,ALK和ROS1基因融合是预测靶向药物克唑替尼(Xalkori®,辉瑞)等ALK/ROS1抑制剂疗效的重要生物标志物,ALK阳性或ROS1阳性的非小细胞肺癌(NSCLC)患者可以从ALK/ROS1抑制剂治疗中获益。2013年2月,国家食品药品监督管理总局(CFDA)批准克唑替尼可用于经CFDA批准的检测方法确定的ALK阳性的局部晚期或转移性NSCLC患者治疗。2016年3月,克唑替尼获得FDA批准用于治疗ROS1阳性的转移性非小细胞肺癌。







