近日,《非小细胞肺癌PD-L1表达临床检测中国专家共识(2023版)》在中华病理学杂志上正式发布。该共识在整合2020版国内PD-L1检测共识基础上,纳入近3年临床诊疗新进展,可以更好指导PD-L1检测在非小细胞肺癌(NSCLC)临床诊疗过程中的规范使用。在本次更新的共识中,艾德生物PD-L1检测试剂盒(克隆号E1L3N,国械注准20223400313)作为免疫治疗伴随诊断国产试剂的代表产品获得优先推荐。
《中华病理学杂志》2023版PD-L1共识原文首页图片
本次专家共识更新的内容,汇总如下:
更新1:
PD-L1表达可作为帕博利珠单抗单药及阿替利珠单抗单药一线治疗的伴随诊断,且PD-L1表达水平越高,患者总生存获益越明显。
更新2:
推荐手术后IB-IIIA期的NSCLC患者进行PD-L1检测,以指导后续免疫辅助治疗。
更新3:
对于新辅助免疫联合化疗的NSCLC患者,建议术前进行PD-L1免疫组织化学检测。
更新4:
补充克隆号SP142作为阿替利珠单抗晚期一线治疗的伴随诊断,优先推荐; 克隆号E1L3N作为帕博利珠单抗晚期一线治疗的伴随诊断,优先推荐,以及作为纳武利尤单抗治疗的相关检测,推荐使用;克隆号SP263应作为阿替利珠单抗术后辅助治疗的伴随诊断试剂使用,但尚未被NMPA批准为该适应症的伴随诊断,目前可推荐使用。其他新型克隆号抗体暂不推荐。
更新5:
克隆号22C3、SP263、E1L3N抗体染色结果的一致性较高,在PD-L1低表达病例中,其灵敏度均高于克隆号SP142;初步研究结果提示,不同克隆号抗体染色筛选的病例其临床疗效获益相似。
更新6:
样本储存时间和温度、湿度等条件,以及脱钙液对不同种类的抗体染色影响程度不同,靶向蛋白细胞内结构域型抗体如克隆号E1L3N、SP142、SP263受影响程度可能较小。
更新7:
NSCLC PD-L1表达异质性存在于肿瘤的整个诊疗阶段,选择组织进行检测时,应首选最能代表肿瘤进展的肿瘤部位,或手术标本中肿瘤组织分化最差的区域进行检测;对多个活检块/条组织推荐均应进行PD-L1检测,并重视TPS/肿瘤细胞数值最高的结果。
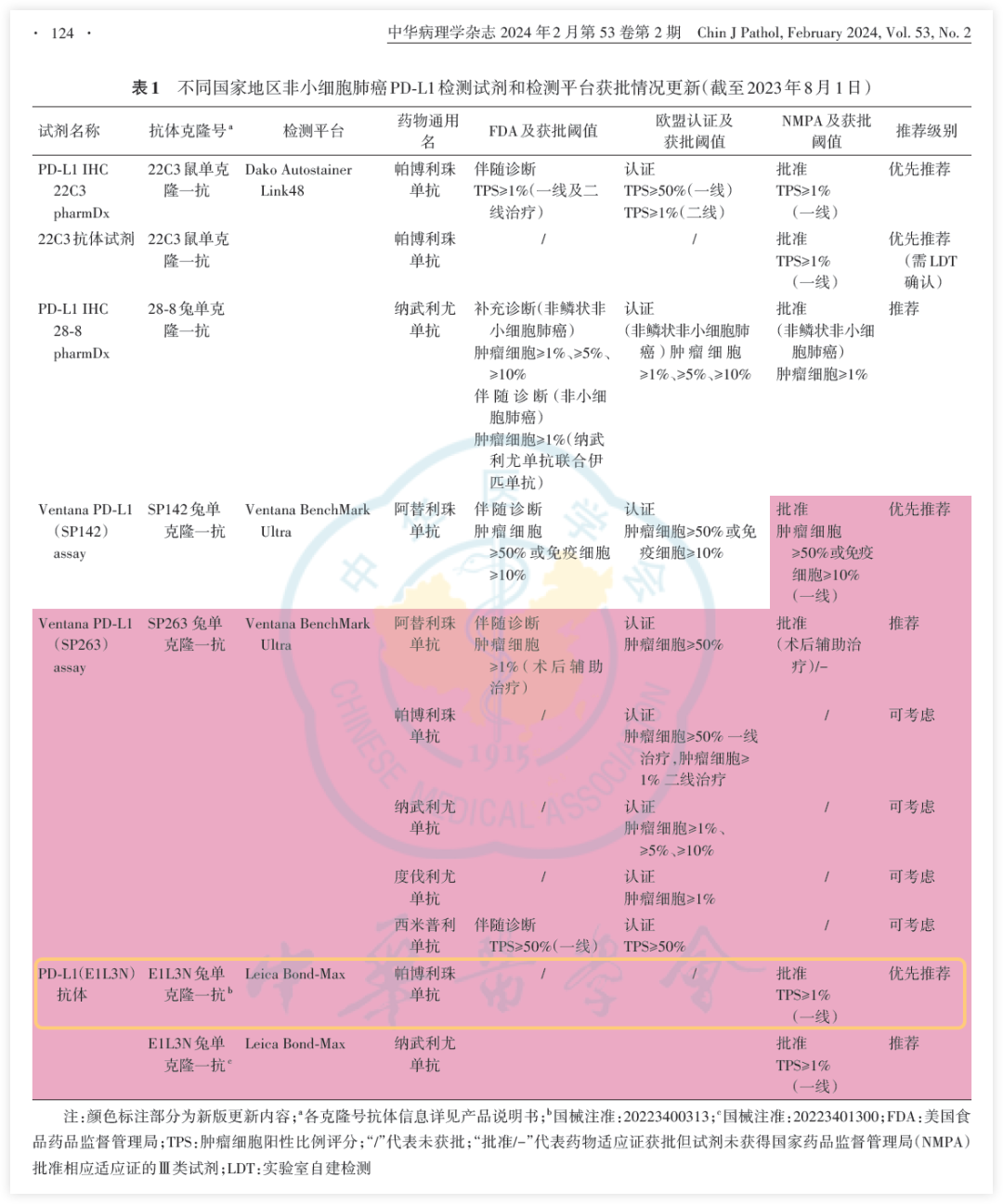
《中华病理学杂志》2023版PD-L1共识关于检测试剂和平台的推荐更新
艾德生物PD-L1检测试剂盒于2022年3月获国家药监局批准用作帕博利珠单抗的伴随诊断,是我国首个批准上市的免疫治疗伴随诊断国产试剂,与22C3单抗检测结果高度一致,而且创新即用型设计实现了临床快速检测。同时,突破不同检测平台壁垒,可在Leica、Ventana、DAKO等多个检测平台上使用,便于PD-L1检测在医院普及使用,造福广大的肿瘤患者。
关于艾德生物(股票代码:300685)
厦门艾德生物医药科技股份有限公司(股票代码:300685)聚焦在肿瘤精准医疗分子诊断领域,专注于科技惠民的技术创新,致力为患者提供合规、高品质的诊断产品和服务,让患者从精准医疗中真正获益。公司拥有国家企业技术中心、博士后科研工作站等资质,GMP标准厂房获得国家药监局(NMPA)和欧盟ISO13485资质认证;公司拥有ADx-ARMS®、Super-ARMS®、ddCapture®、ADx-HANDLE®等核心技术,核心技术获中、美、日、欧专利授权,荣获国家发明专利银奖,国家科技进步奖二等奖;公司产品覆盖具备精准医疗条件的各大癌种,多个产品至今尚无竞品,部分产品在日本、韩国获批上市并进入当地医保,开创了我国肿瘤伴随诊断海外获批的先例。公司下设厦门艾德医学检验所、上海厦维医学检验实验室,拥有医疗机构执业许可证、通过美国病理学会(CAP)认证,专业从事第三方临检服务。目前全球数十个国家和地区的数百家大中型医院选择了艾德产品,每年有数十万肿瘤患者从中受益。此外,艾德瞄准行业创新源头,以伴随诊断赋能原研药物临床,是众多顶级制药企业肿瘤伴随诊断的战略合作伙伴,是国际知名的民族品牌。





